技術説明「酸素濃度計測定原理」
-
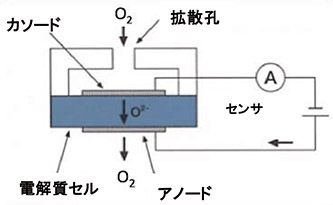
ガルバニ電池式
アルカリ性の電解液の反応(水酸化カリウム)
陽極 2Pb+4OH- → 2PbO+2H2O+4e-
鉛陽極が酸化反応を行う事により、陰極での還元反応を助けます。酸素により陽極で燃焼が発生しいるかの如く振舞い電流を発生するので、燃料電池式とも呼ばれます。陽極での酸化、陰極での還元反応を同時に引き起こし、鉛1原子に対し電子2個が発生します。
陰極 O2+2H2O+4e- → 4OH-
酸素分子1に対し電子4を受取り、還元反応が起こります。陰極では酸素と水分だけが反応するので、不活性金属であるプラチナ、金、銀等が陰極として使用されます。
上記の反応により発生する電流値は、透過酸素量に正比例することから、測定対象ガスの酸素濃度を測定する事ができます。酸性の電解液の反応(酢酸)
陽極 2Pb+4OH- → 2PbO+2H2O+4e-
陰極 O2+2H2O+4e- → 4OH-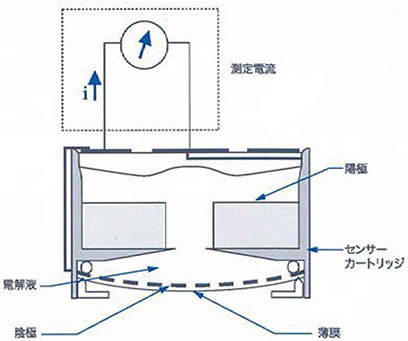
-
硫化水素
酸素濃度計の原理と同等で、H2Sの酸化反応を利用してガス濃度を測定します。
この反応ではガス濃度に比例した電流が発生します。
これらのセンサーは非常に高精度で再現性が高く、微量レベルのH2Sも検出可能です。
以下の反応式になります。陽極 H2S+4H2O → SO42-+10H++8e-
陰極 4MO+8H++8e- → 4M+4OH-+4H+
溶液内 2H++SO42-
ジルコニア式(濃淡電池式)
既知の基準ガスとネルンストの方程式を用いて未知のプロセスガスを比較。センサーの起電力を測定し酸素濃度を測定。
ジルコニアセンサーが高温動作状態の時、陰極では酸素が電子をもらって酸素イオン(還元反応)になり、陽極では酸素イオンが電子を離して酸素(酸化反応)になります。陰極 O2+4e → 2(O2)- 還元反応
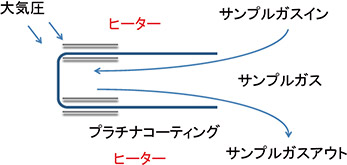
ジルコニア式(限界電流式)
測定ガスの中の酸素濃度に比例して電流が流れる現象を利用。電解質に吸入する酸素を含むガス量を制限すると電圧を増加しても電流値が一定値になる飽和現象(限界電流)が発生します。
この限界電流は酸素濃度に比例するので流れる電流値より酸素濃度を検出します。